Persamaan umum suatu gas adalah persamaan yang dapat memberikan hubungan antara tekanan, volume dan suhu gas dalam suatu tempat. Kitaikan kita memiliki satu tangki gas sembarang, kemudian tekanan dalam tangki kita sebut P, volume tangki adalah V, dan suhu dalam tangki adalah T. Kita bisa mengatur atau mengubah tekanan, suhu maupun volumenya. Ternyata antara P,V dan T saling memiliki kaitan tertentu. Persamaan yang meghubungkan antara P, V dan T dinamakan sebagai persamaan keadaan gas. Kita akan meninjau persamaan keadaan untuk gas ideal.
Persamaan Umum Gas
Bila tekanan dalam tangki kita ubah dan suhunya kita jaga agar tidak berubah atau suhunya konstan, ternyata volumenya ikut berubah. Jika kita memperbesar tekanan maka volumenya berkurang. Apabila kita memperbesar volume tangki ternyata tekanan akan mengecil. Jadi tekanan berubah berbanding terbalik dengan volumenya. Robert Boyle menemukan secara eksperimen bahwa :
PV = konstan pada temperatur konstan
Gas dalam suatu tanki, volumenya dapat berubah. Pada suhu yang kita buat konstan ternyata jika volumenya diperkecil tekanan akan membesar.
Hukum ini berlaku hampir untuk semua gas dengan kerapatan rendah.
Apabila sekarang tekanan kita jaga agar tetap, kemudian volume tangki kita ubah ternyata jika volume kita perbesar maka suhu dalam tangki naik. Kenaikan suhu sebanding dengan volumenya. Sifat ini berlaku untuk gas dengan kerapatan rendah. Jacques Charles dan Gay Lussac menemukan bahwa pada gas dengan kerapatan rendah berlaku :
PV = CT
C adalah konstanta kesebandingan. T adalah suhu mutlak. Satuan T adalah Kelvin, t suhu dalam satuan Celcius.
T = t + 273
Berapa besar C ? Misalkan kita punya dua wadah, tiap-tiap wadah tempat berisi jenis gas yang sama dan jumlah gas yang sama. Apabila kedua tempat tersebut kita satukan maka volumenya akan membesar menjadi dua kali. Tekanan dan suhunya tetap. Dengan demikian konstanta Cmenjadi dua kali semula. Hal ini berarti C sebanding dengan jumlah gas, atau dapat kita tuliskan sebagai :
C = kN
k adalah konstanta yang baru, N adalah jumlah molekul gas. Persamaan diatas sekarang dapat kita tuliskan menjadi :
PV = NkT
Konstanta k disebut konstanta Boltzmann. Secara eksperimen nilai k adalah :
k = 1,381 * 10-23 J/K
Persamaan keadaan untuk gas dengan kerapatan rendah menjadi :
PV = nNakT = nRT
R= kNa adalah konstanta gas umum, nilainya untuk semua gas adalah R = 8,314 J/mol. K = 0,08206 L.atm/mol.K
Untuk gas nyata, nilai PV/nT sangat mendekati konstan sampai pada range tekanan yang besar, kita bisa melihatnya pada gambar berikut.
Untuk gas ideal nilai PV/nRT adalah konstan. Ini berlaku untuk tekanan rendah. Pada umumnya masih berlaku sampai tekanan beberapa atm. (Tipler, Fisika 1)
Persamaan Umum Gas Ideal
Gas ideal didefinisikan sebagai gas di mana PV/nT bernilai konstan untuk seluruh keadaan. Jadigas ideal memenuhi persamaan :
PV = nRT
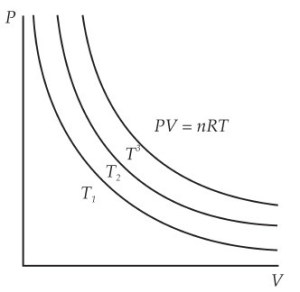
Kurva Isoterm Gas Ideal
Gambar berikut merupakan kurva keadaan isoterm untuk tiap T pada gas ideal.
Menunjukkan kaitan P dan V pada suhu tertentu. V diubah-ubah pada suhu yang konstan. Keadaan ini dinamakan isoterm. Kurva pada gambar menunjukkan kurva isoterm. (Tipler , Fisika 1)
Nilai nR pada persamaan diatas adalah konstan sehingga kita bisa menuliskan :
atau
Kita sering membaca gas dalam keadaan standar. Apa yang dimaksud dengan pada keadaan standar? Keadaan standar adalah keadaan gas pada saat tekanannya 1 atm = 101 kPa dan suhu mutlak 273 K atau 0°C. Berapa volume 1 mol gas pada keadaan standar? Dari persamaan volume gas kita bisa menghitung volume gas.
V = 22,4 L
Pada keadaan standart volume gas apapun adalah 22,4 l.






Tidak ada komentar:
Posting Komentar