Hukum pertama termodinamika sebenarnya adalah kekekalan tenaga yang menghubungkan antara usaha yang dilakukan pada sistem,panas yang ditambahkan atau dikurangkan, dan tenaga dalam sistem. Jika usaha dilakukan oleh sistem pada lingkungan misalkan gas mengembang sehingga volume tabung membesar maka usaha W bertanda positif (+). Jika usaha dilakukan pada sistem, misalkan volume mengecil maka dilakukan usaha pada sistem atau W bertanda negatif (-). Jika positif artinya panas diberikan kepada sistem, Q bertanda negatif jika panas keluar dari sistem.
Hukum Pertama Termodinamika
Apa yang kita perkirakan akan terjadi jika sejumlah gas dalam suatu ruang tertutup dipanaskan? Keadaan yang langsung bisa dilihat suhunya naik dan mungkin volumenya bertambah. Kejadian inilah yang dijelaskan pada hukum I Termodinamika.
Panas yang ditambahkan pada suatu sistem sama dengan perubahan energi internal sistem ditambah usaha yang dilakukan oleh sistem.
Hubungan di atas dapat dinamakan kekekalan energi dan dituliskan sebagai berikut.
Q = ΔU W
Kita telah mempelajari berbagai proses dan usaha tiap proses.
Proses-proses Termodinamika
Proses termodinamika adalah perubahan keadaan gas, yaitu tekanan, volume dan suhunya. Perubahan ini diiringi dengan perubahan kalor, usaha dan energi dalamnya. Proses-proses yang memiliki sifat-sifat khusus ada empat contoh seperti berikut.
Proses Isobarik
Proses isobarik adalah proses perubahan gas dengan tahanan tetap. Pada garis P – V proses isobarik dapat digambarkan seperti pada gambar berikut.
Usaha proses isobarik dapat ditentukan dari luas kurva di bawah gra fik P – V.
W = P (VB – VA)
Untuk proses isobarik usaha yang dilakukan gas adalah W = PΔV maka hukum termodinamika pertama menjadi:
Q = ΔU + PΔV
Proses Isotermis
Proses isotermis adalah proses perubahan gas dengan suhu tetap. Perhatikan grafik k pada gambar dibawah. Pada proses ini berlaku hukum Boyle.
Pada proses isotermik usaha yang diakukan gas adalah  karena suhu konstan maka energi dalam sistem juga konstan atau ΔU = 0. Hukum termodinamika pertama menjadi :
karena suhu konstan maka energi dalam sistem juga konstan atau ΔU = 0. Hukum termodinamika pertama menjadi :
Proses Isokhoris
Proses isokhoris adalah proses perubahan gas dengan volume tetap. Pada grafik P.V dapat digambarkan seperti pada gambar dibawah. Karena volumenya tetap berarti usaha pada gas ini nol, W = 0.
Pada proses isokorik, usaha yang dilakukan gas adalah nol, maka Q =ΔU. Dengan demikian semua kalor yang masuk digunakan untuk menaikkan tenaga dalam sistem.
Proses Adiabatis
Pada proses isotermis sudah kita ketahui, U = 0 dan pada proses isokoris, W = 0. Bagaiaman jika terjadi proses termodinamika tetapi Q = 0 ? Proses yang inilah yang dinamakan proses adiabatis. Berdasarkan hukum I Termodinamika maka proses adiabatis memiliki sifat dibawah.
Q = 0
W = -ΔU
Proses lain dan gabungan proses
Proses-proses selain 4 proses ideal diatas dapat terjadi. Untuk memudahkan penyelesaian dapat digambarkan grafik P – V prosesnya. Dari grafik tersebut dapat ditentukan usaha proses sama dengan luas kurva dan perubahan energi dalamnya 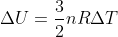 . Sedangkan gabungan proses adalah gabungan dua proses adiabatis yang berkelanjutan. Pada gabungan proses ini berlaku hukum pertama termodinamika secara menyeluruh.
. Sedangkan gabungan proses adalah gabungan dua proses adiabatis yang berkelanjutan. Pada gabungan proses ini berlaku hukum pertama termodinamika secara menyeluruh.









Tidak ada komentar:
Posting Komentar