Penentuan skala keasaman dan kebasaan dapat kita ketahui dengan mengukur tingkat keasaman dan kebasaan suatu senyawa dapat diketahui dari nilai pH (power of hydrogen).
Penentuan Skala Keasaman Dan Kebasaan
Tingkat pH berkisar antara 0 sampai 14. Nilai 7 menunjukkan suatu zat bersifat netral (tidak asam dan tidak basa). Suatu senyawa dikatakan bersifat asam jika mempunyai nilai pH yang lebih kecil daripada 7. Senyawa basa mempunyai nilai pH yang lebih besar daripada 7. Perhatikan skala pH dan warna standar yang ditunjukkan oleh indikator pada gambar berikut.
Jika ujung kertas indikator kamu masukkan ke dalam suatu larutan, tiga jenis indikator asam-basa pada kertas itu akan berubah warna. Untuk mengetahui pH-nya, bandingkan ketiga warna pada kertas dengan warna standar pada wadah.
Derajat keasaman suatu senyawa berbeda-beda. Ada yang bersifat asam kuat dan ada pula yang bersifat asam lemah. Semakin kecil nilai pH atau semakin mendekati skala nol, maka tingkat keasamannya semakin kuat. Sebaliknya, jika nilai pH semakin besar atau mendekati skala 7, maka tingkat keasamannya semakin lemah.
Begitu juga dengan basa, semakin besar nilai pH atau semakin mendekati nilai 14 maka tingkat kebasaannya semakin kuat. Sebaliknya, jika nilai pH semakin kecil atau semakin mendekati nilai 7 maka tingkat kebasaannya semakin lemah.
Kekuatan Asam dan Basa
Kekuatan suatu asam atau basa tergantung bagaimana senyawa tersebut dapat diuraikan menjadi ion-ion dalam air. Peristiwa terurainya suatu zat menjadi ion-ionnya dalam air disebut ionisasi. Asam atau basa yang terionisasi secara sempurna dalam larutan merupakan asam kuat atau basa kuat. Sebaliknya asam atau basa yang hanya terionisasi sebagian merupakan asam lemah atau basa lemah.
Jika ingin mengetahui kekuatan asam dan basa kamu dapat melakukan percobaan sederhana. Perhatikan nyala lampu saat mengadakan percobaan uji larutan elektrolit. Bila nyala lampu redup berarti larutan tergolong asam atau basa lemah, sebaliknya apabila nyala lampu terang berarti larutan tersebut tergolong asam atau basa kuat.
 Asam kuat atau asam lemah pada konsentrasi yang sama menghantarkan listrik yang berbeda. Nyala lampu pada gambar (a) diatas tampak redup. Ini berarti larutan yang diuji berupa asam lemah atau basa lemah. Adapun pada gambar (b) lampu menyala terang, menandakan bahwa larutan yang diuji berupa asam kuat atau basa kuat.
Asam kuat atau asam lemah pada konsentrasi yang sama menghantarkan listrik yang berbeda. Nyala lampu pada gambar (a) diatas tampak redup. Ini berarti larutan yang diuji berupa asam lemah atau basa lemah. Adapun pada gambar (b) lampu menyala terang, menandakan bahwa larutan yang diuji berupa asam kuat atau basa kuat.Derajat Keasaman dan Kebasaan (pH dan pOH)
Pada dasarnya derajat/tingkat keasaman suatu larutan (pH = potenz Hydrogen)) bergantung pada konsentrasi ion H+ dalam larutan. Semakin besar konsentrasi ion H+ semakin asam larutan tersebut.
Umumnya konsentrasi ion H+ pada larutan sangat kecil, maka untuk menyederhanakan penulisan digunakan konsep pH untuk menyatakan konsentrasi ion H+. Nilai pH sama dengan negatif logaritma konsentrasi ion H+ dan secara matematika dinyatakan dengan persamaan.
pH = – log (H+)
Analog dengan pH, konsentrasi ion OH– juga dapat dinyatakan dengan cara yang sama, yaitu pOH (Potenz Hydroxide) dinyatakan dengan persamaan berikut.
pOH = – log (OH-)
Derajat keasaman suatu zat (pH) ditunjukkan dengan skala 0—14.
- Larutan dengan pH < 7 bersifat asam.
- Larutan dengan pH = 7 bersifat netral.
- Larutan dengan pH > 7 bersifat basa.
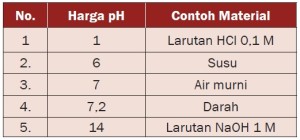
Jumlah harga pH dan pOH = 14. Misalnya, suatu larutan memiliki pOH = 5, maka harga pH = 14 – 5 = 9. Harga pH untuk beberapa jenis zat yang dapat kita temukan di lingkungan sehari-hari dinyatakan dalam tabel berikut.
Penentuan Skala Keasaman Dan Kebasaan Dengan Menentukan pH Suatu Larutan
Derajat keasaman (pH) suatu larutan dapat ditentukan menggunakan indikator universal,indikator stick, larutan indiaktor, dan pH meter.
a. Indikator Universal
Indikator universal merupakan campuran dari bermacammacam indikator yang dapat menunjukkan pH suatu larutan dari perubahan warnanya. Indikator universal ada dua macam yaitu indikator yang berupa kertas dan larutan.
b. Indikator Kertas (Indikator Stick)
Indikator kertas berupa kertas serap dan tiap kotak kemasan indikator jenis ini dilengkapi dengan peta warna. Penggunaannya sangat sederhana, sehelai indikator dicelupkan ke dalam larutan yang akan diukur pH-nya. Kemudian dibandingkan dengan peta warna yang tersedia.
c. Larutan Indikator
Salah satu contoh indikator universal jenis larutan adalah larutan metil jingga (Metil Orange = MO). Pada pH kurang dari 6 larutan ini berwarna jingga, sedangkan pada pH lebih dari 7 warnanya menjadi kuning.
d. pH Meter
Pengujian sifat larutan asam basa dapat juga menggunakan pH meter. Penggunaan alat ini dengan cara dicelupkan pada larutan yang akan diuji, pada pH meter akan muncul angka skala yang menunjukkan pH larutan.
pH meter untuk penentuan skala keasaman dan kebasaan








Tidak ada komentar:
Posting Komentar